період опрацювання з 26.04.21.
1. Загальна характеристика амінокислот
 Амінокислоти — органічні сполуки, в молекулі яких одночасно містяться дві функціональні групи: аміногрупа -NH2 і карбоксильна група -СООН.
Амінокислоти — органічні сполуки, в молекулі яких одночасно містяться дві функціональні групи: аміногрупа -NH2 і карбоксильна група -СООН.Білки складаються із залишків молекул амінокислот сполучених пептидними зв'язками.
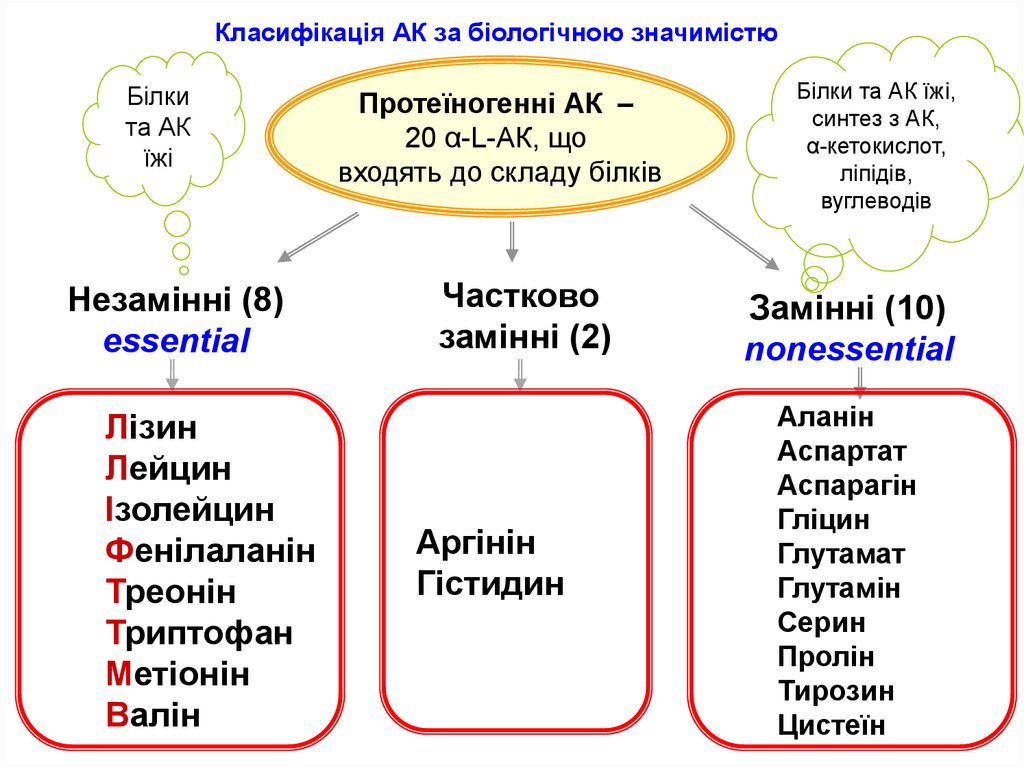
Двадцять амінокислот, з яких побудовані білки, називають стандартними або протеїногенними амінокислотами.
У залежності від того, до якого атому Карбону приєднана аміногрупа, амінокислоти поділяються на α-, β-, γ- тощо. У α-амінокислотах карбоксильна група і аміногрупа приєднані до одного атома Карбону.
Усі протеїногенні амінокислоти є α-амінокислотами. Їх загальна формула:
2. Номенклатура амінокислот
За систематичною номенклатурою назви амінокислот утворюються від назв відповідних карбонових кислот додаванням префікса аміно- і номера атома, від якого відходить аміногрупа. Наприклад: 2-амінобутанова кислота.
Для α-амінокислот, які входять до складу білків, використовують тривіальні назви.
Білки.
Структура білків
- Первинна структура – послідовне лінійне сполучення залишків амінокислот, сполучених пептидними зв’язками
- Вторинна структура – спіраль, витки якої сполучені водневими зв’язками
- Третина структура – глобула або фібрила, зв’язки водневі, гідрофобні, йонні
- Четвертинна структура – поєднання кількох білкових молекул, зустрічається лише в частини білків. Найвідоміший білок з четвертинною будовою молекули — гемоглобін.
- Хімічні властивості білківДенатурація білка — це руйнування четвертинної, третинної і вторинної структури білка. Вона може бути викликана нагріванням, дією радіації, струшуванням. Денатурація білка відбувається при варінні яєць, приготуванні їжі тощо.Ренатурація — це процес, оборотний денатурації, при якому білки, повертають свою третинну і вторинну структуру.Денатурація — руйнування вищих рівнів структурної організації білка – вторинной, третинної, четвертинної.Денатурація буває оборотна і необоротна.Оборотна денатурація — від механічної дії, солей, слабких кислот.Процес відновлення структури білка називається ренатурація.Необоротна денатурація — вплив високої температури, концентрованих розчинів кислот, лугів, солей важких металів.
Якісна реакція на білок
Повторення. Виведення формул речовин за масовими частками елементів.